Чем отличается эхокартина овотестиса от таковой при крипторхизме?
Метки: Последние публикации, УЗИ малого таза, андрология, гинекология, дайджест, новости, педиатрия, урология, эндокринология
Содержание:
По данным публикации в журнале Исследования гормонов в педиатрии (Hormone Research in Paediatrics) за 2017 - The Effect of the Testis on the Ovary: Structure-Function Relationships in a Neonate with a Unilateral Ovotestis (Ovotesticular Disorder of Sex Development) / Влияние яичка на яичник: структурно-функциональные отношения у новорожденного с односторонним овотестисом (овотестикулярное нарушение полового развития) - внешняя ссылка
Овотестикулярное нарушение половой дифференциации (НПД), также называемое истинным гермафродитизмом, определяется наличием как функциональной ткани яичника, так и ткани яичка. Овотестикулярное НПД составляет около одного процента от промежуточных гениталий и является результатом частичной маскулинизации тканью яичка. Секреция эстрадиола у детей с овотестикулярным НПД в возрасте до 5 месяцев происходит в ответ на введение экзогенных гонадотропинов, также овуляция и беременность отмечались в нескольких случаях овотестикулярного НПД. Поскольку пубертатная нейроэндокринно-гонадная ось временно активирована у новорожденных («минипубертат новорожденных»), можно ожидать, что при овотестикулярном НПД функция яичников и яичек будет обнаруживаться неонатально, хотя авторам публикации не известно ни одного предыдущего исследования этой возможности.
В представленном случае с промежуточными гениталиями вследствие овотестикулярного НПД, изученного в течение 2 недель, авторы публикации обнаружили, что функция яичника не была заметна при наличии функции яичка, но гиперфункция яичника быстро возникала после удаления ткани яичка. Исследования авторов публикации предполагают роль в неонатальном периоде секреции тестикулярного анти-Мюллерового гормона (АМГ) в подавлении развития и функции фолликулов яичника и секреции тестостерона яичка в определении стадии гиперфункции яичников после удаления овотестиса.
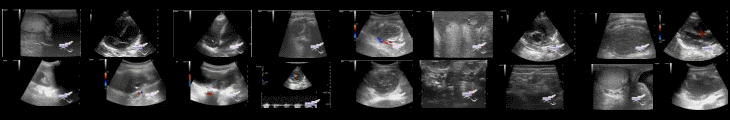
Пациентка родилась доношенной от первородящей 21-летней матери, у которой во время беременности отмечалось небольшое увеличение гирсутизма в брюшной полости. Промежуточные гениталии были обнаружены при рождении: фаллос имел длину 3,5 см с промежностной гипоспадией и сросшимися вирилизированными лабиоскротальными складками; Гонады не пальпировались. УЗИ выявило хорошо развитую матку и влагалище, а также гонады в паху и малом тазу без заметных фолликулов яичников(*на одной эхограмме визуально крипторхизм, т.е. эхокартина неопустившегося яичка). Кариотип периферической крови был 46 XX, флуоресцентная гибридизация in situ для SRY была отрицательной. На 6 день жизни (ДЖ) уровень тестостерона в плазме составлял 77 нг/дл, DHEAS(*Дегидроэпиандростерон) 105 мкг/дл и эстрадиола 7 пг/мл. Врожденная гиперплазия надпочечников была исключена ничем не примечательной картиной предшественников кортизола, в то время как незначительные уровни андростендиона делали дефицит ароматазы маловероятным. Плазменный тестостерон оставался высоким (113 нг/дл) после подавления дексаметазоном функции надпочечников, что снижало DHEAS до <15 и кортизол до <0,3 мкг/дл. Тестирование агониста гонадотропин-рилизинг-гормона (GnRHag) на 12 ДЖ выявило уровень лютеинизирующего и фолликулостимулирующего гормона сыворотки взрослых мужчин (LH, FSH) и тестостерона до и после стимуляции, но базовый уровень препубертатного эстрадиола. АМГ в сыворотке крови составлял 28 нг/мл, что очень высоко для женщины и приближается к нижнему пределу нормального мужского диапазона. Свидетельство функции яичка у новорожденного с 46 XX НПД предполагало овотестикулярное НПД, хотя не было никаких признаков функционирования ткани яичника.
Лапароскопия на 31 ДЖ показала овотестис в левой паховой области с прикрепленными эпидидимусом и дистальным участком фаллопиевой трубы, а также нормально выглядящий яичник и фаллопиеву трубу в малом тазу справа, прикрепленные к нормальной матке. После того, как во время операции замороженные срезы выявили ткань яичка без четкого разграничения между компонентами яичка и яичника, овотестис и прикрепленные структуры были удалены, чтобы оптимизировать потенциальную женскую фертильность. Эксцизионная биопсия левой гонады показала компоненты как яичка, так и яичника (только с первичными фолликулами) без чистой демаркации, в то время как после биопсии правого яичника были обнаружены нормальные примордиальные фолликулы по всей строме с предположительным частичным переходом к первичным фолликулам без дальнейшего развития. Хромосомный анализ интраоперационных тканей выявил мозаичный хромосомный паттерн в обеих гонадах: ovotestis: 41/50 (82%) 46 XX; 9/50 (18%) 47 XX + mar.ishi (Y) (p10) (SRY ++); яичник: 47/50 (94%) 46 XX; 3/50 (6%) 47 XX + mar.ishi (Y) (p10) (SRY ++); кожа: 50/50 (100%) 46 XX (–SRY). Y-хромосома имела вид изохромосомы с двумя копиями короткого плеча, соединенного вместе.
Функция яичника после удаления овотестиса
После орхиэктомии (т.е. удаления овотеста) на 31 ДЖ повторное тестирование проводили в несколько этапов, в некоторых случаях с отбором проб после стимуляции с помощью GnRHag. На 58 ДЖ через 4 недели после орхиэктомии уровень АМГ в сыворотке резко снизился до минимального уровня для обоих полов (0,2 нг/мл). Тем не менее, уровень тестостерона снизился только до 62 нг/дл, оставаясь выше диапазона для взрослых женщин (15–50). Это совпадало с гиперфункцией оставшегося правого яичника: базовый уровень эстрадиола составлял 390 пг/мл (19–95), ингибина B 732 пг/мл (<16–73) и ингибина A 43 пг/мл (<20). В это время тест стимуляции GnRHag показал, что сывороточный ЛГ находится на пубертатном уровне, а ФСГ подавлен, эстрадиол увеличился до 729 пг/мл, а тестостерон увеличился до 82 нг/дл. На 80 ДЖ, хотя эстрадиол (199 пг/мл) и тестостерон (59 нг/дл) снижались, они оставались выше нормального зрелого женского диапазона. В это время было зарегистрировано, что яичник вырос до взрослого размера и содержал два фолликула преовуляторного размера. Производство стероидов высокого пола постепенно уменьшалось со временем, параллельно с уровнем гонадотропина, а также объемом яичников, количеством и размером фолликулов. К 114 ДЖ уровень эстрадиола в сыворотке снизился до пубертатного уровня (44 пг/мл), а уровень тестостерона был <10 нг/дл. Поскольку повышение уровня тестостерона было настолько длительным, был проведен тест GnRHag, чтобы определить, имел ли ребенок ответ тестостерона, свидетельствующий о наличии остатка яичка: не было ответа тестостерона яичка, но 17ОПГ(17-оксипрогестерон или 17-гидроксипрогестерон) заметно вырос (от <25 до 330 нг/дл). Пубертатные уровни ЛГ (9,8 МЕ/л) и эстрадиола (19 пг/мл) были получены на 222 ДЖ, когда объем яичников составлял 2,97 мл (верхний уровень нормы для возраста) с множественными фолликулами 2–8 мм. В возрасте 1,6 лет объем яичников еще больше сократился (1,85 мл), фолликулы диаметром 2,8 и 5,1 мм; в возрасте 3 лет объем яичников снизился до 1,1 мл и эстрадиола (<10 пг/мл), тестостерона (<10 нг/дл), ЛГ (<0,1 МЕ/л), ФСГ (3,4 МЕ/л) и АМГ (0,9 нг/мл) были препубертатными. Между тем, в возрасте 7 месяцев семья выбрала феминизирующую генитопластику после соответствующего консультирования.
Проявления овотестикулярного НПД могут быть различны по спектру от нормального женского до нормального мужского фенотипов. В большинстве случаев НПД есть промежуточные гениталии, которые иногда очень обманчиво выглядят. У данного пациента были явно промежуточные гениталии, поэтому выводы авторов публикации являются уместными для большинства случаев пациентов с овотестикулярным НПД.
Клиническая картина указывает на то, что в утробе овотестисы этого пациента вырабатывали недостаточное количество тестостерона для полной маскулинизации гениталий, что объясняет промежуточность наружных половых органов и персистенцию неполных производных вольфова протока, и вырабатывали недостаточный АМГ для ингибирования образования мюллеровской системы, которая объясняет наличие нормальной матки и маточных труб. Тестостерон, секретируемый яичком плода в критический период для половой дифференцировки, необходим для формирования нормального полового члена и дифференцировки вольфова протока в эпидидимус и семенной проток. Секреция АМГ клетками Сертоли в яичках плода в этот критический период вызывает паракринное подавление дифференцировки мюллеровской системы, таким образом ингибируя ипсилатеральную дифференцировку маточных труб и матки. АМГ не секретируется клетками гранулезы яичника до тех пор, пока развитие преантрального и антрального фолликулов не начнется примерно через 36 недель беременности.
Неонатально, после того, как фетоплацентарные гормоны уменьшаются в течение первых 5–6 дней жизни, уровни гонадотропина в сыворотке обычно повышаются до пубертатного диапазона к 1 неделе, а уровень тестостерона в сыворотке у мальчиков и девочек различается на 9 день жизни. Максимальная выработка половых гормонов наблюдается в среднем примерно через 2 месяца у мальчиков и через 4 месяца у девочек и после этого снижается до препубертатного уровня детства. Функция половых желез у девочек относительно менее устойчива, чем у мальчиков: в то время как уровни тестостерона в сыворотке у мальчиков повышаются до среднего уровня в зрелом возрасте в течение 2-3 месяцев жизни, уровни эстрадиола в сыворотке у девочек колеблются вокруг раннего периода пубертатного периода. Скудные имеющиеся данные свидетельствуют о том, что в раннем младенчестве гормональные реакции девочек на GnRHag сопоставимы с таковыми у пубертатных девочек и, таким образом, могут быть лучше, чем базовые уровни, при различении препубертатной и пубертатной гипофизарно-гонадной функции, которая является промежуточной между препубертатной и взрослой функциями. К 6 месяцам уровень тестостерона у мальчиков обычно падает до уровней, совместимых с происхождением надпочечниковой зоны плода, но у девочек уровни половых гормонов могут сохраняться в течение 2-3 лет. Продукция АМГ увеличивается с ростом новорожденных и развитием гонад в ответ на гонадотропины, причем уровни АМГ в сыворотке у мальчиков намного превышают уровни девочек до полового созревания, когда уровень АМГ в сыворотке падает у мальчиков.
Это исследование новорожденного с овотестикулярным НПД впервые предполагает, что наличие функционирующей ткани яичка в течение периода новорожденности глубоко контролирует развитие и функционирование фолликулярных яичников и обеспечивает понимание механизма. Небольшой тестикулярный компонент овотестиса в представленном случае был функционально преобладающим во время неонатального периода активной секреции гонадотропина, несмотря на то, что структура внутреннего полового протока указывает на тестикулярную недостаточность у плода. В течение первого месяца постнатальной жизни у овотестисов обнаруживался сильный мужской паттерн секреции АМГ, а также тестостерона, но не эстрадиола, в ответ на спонтанный и стимулированный уровень гонадотропина, который был сопоставим с таковым у взрослых мужчин. При гистологическом исследовании как удаленного левого овотестиса, так и послеоперационной биопсии правого яичника было показано, что развитие фолликулов яичника остановилось на стадии первичного фолликула, что сопоставимо с таковым у плода 16–19-недельного плода. Таким образом, развитие яичников не достигло стадии антральных фолликулов, на которой секретируется эстрадиол; гистологические наблюдения авторов публикации похожи на другие опубликованные наблюдения. После удаления овотестиса отсутствие ткани яичка было подтверждено быстрым снижением уровня АМГ. Впоследствии контралатеральный яичник подвергся обширному мультифолликулярному расширению и стал гиперфункциональным, уровень эстрадиола в сыворотке значительно выше, а уровень тестостерона несколько выше, чем у взрослых женщин.
АМГ известен из исследований на животных моделях и человеческих фолликулах, культивируемых in vitro, для ингибирования развития фолликулов за пределами стадии первичного фолликула. Полученные данные согласуются с концепцией, согласно которой хотя секреция АМГ в яичке была недостаточной для подавления развития мюллеровской системы, она вырабатывала уровень АМГ в сыворотке, достаточно высокий для того, чтобы остановить развитие фолликулов яичников на стадии первичного фолликула. Таким образом, эти результаты предполагают, что ингибирующий эффект АМГ для яичника проявляется при более низком уровне АМГ, чем эффект АМГ ингибирующий мюллеровскую систему.
Гиперфункция яичников после орхиэктомии произошла в ответ на пубертатные уровни ЛГ, в то время как ФСГ был подавлен. Таким образом, он не только кажется чрезмерным для нормальной женской минипубертатности, он отличается от гиперфункции яичников, которая иногда является следствием уровня гонадотропина в постменопаузе у недоношенных новорожденных девочек. Скорее, это говорит о том, что фолликулы яичников были гиперчувствительны к ЛГ, что, в свою очередь, говорит о том, что они преждевременно лютеинизированы. Преждевременная лютеинизация лежит в основе гиперчувствительности к гонадотропинам при СПКЯ(*синдром поликистозных яичников) и включает неадекватное раннее приобретение рецепторов ЛГ клетками гранулезы; ФСГ является основным индуктором этих рецепторов ЛГ, и андрогены усиливают это и другие действия ФСГ. Таким образом, воздействие андрогена на ребенка в представленном случае вполне может предрасполагать к гиперфункции яичников по типу СПКЯ.
*Также в публикации представлены снимки УЗИ.
*комментарии редактора