Случай острой сердечной недостаточности у годовалого ребенка с эндокардиальным фиброэластозом
Метки: Последние публикации, ЭхоКГ, дайджест, кардиология, новости, педиатрия, эхокардиография
Содержание:
По данным публикации в Международном журнале Клинических Случаев (World Journal of Clinical Cases) за март 2023: Pediatric acute heart failure caused by endocardial fibroelastosis mimicking dilated cardiomyopathy: A case report / Детская острая сердечная недостаточность, вызванная эндокардиальным фиброэластозом, имитирующим дилатационную кардиомиопатию: клинический случай - внешняя ссылка
13-месячная девочка поступила в больницу с позывами на рвоту в течение 1 недели и ухудшением состояния в течение 2 дней.
У ребенка была рвота без явных триггеров в течение 1 недели до поступления в больницу, но рвоты не было. Семья ребенка отрицала, что у ребенка в анамнезе были лихорадка, сыпь, кашель, отхаркивание, желтуха, диарея и травма. В амбулаторных анализах крови гемоглобин (ГГБ) 84,00 г/л, С-реактивный белок (СРБ) 0,30 мг/л, способность связывания углекислого газа (СО2СВ) 15,70 ммоль/л. В течение болезни у ребенка отмечался плохой аппетит, плохой сон, удовлетворительное психическое состояние, снижение диуреза, но нарушений опорожнения и дефекации не было. Других сопутствующих симптомов, в том числе признаков инфекции верхних дыхательных путей, у ребенка не было.
Ребенок был госпитализирован в отделение неонатологии 1 год назад с диагнозом: неонатальная гипербилирубинемия (НГБ), неонатальная билирубиновая энцефалопатия (НБЭ), врожденная киста печени (ВКП), врожденные двусторонние множественные кисты почки (ВРКП). НГБ и НБЭ благополучно ушли после активного лечения. Кисты печени и почек вели консервативно, цветное УЗИ печени и почек проводили раз в 2 года. Анемия была обнаружена в возрасте 8 месяцев с минимальным уровнем ГГБ около 34 г/л. После лечения пероральными препаратами и диетической терапией максимальное значение ГГБ составляло около 80 г/л. В анамнезе у ребенка не было хирургических вмешательств или переливаний крови.
Ребенок родился от матери с 1 беременностью и 1 родами. Роды были вагинальными на сроке 38+2 нед гестации с массой тела при рождении 2750 г. Она находилась на грудном вскармливании, с нормальным ростом и основными этапами развития, без существенной истории лекарственной или пищевой аллергии. Родители ребенка были здоровы, в семейном анамнезе патологии не было.
Рост ребенка 74 см, вес 9,5 кг, температура тела 36,4 °С, частота пульса 150/мин, частота дыхания 68/мин, артериальное давление 77/64 мм рт.ст., общее состояние неудовлетворительное, тахипноэ, анемичный вид. При физикальном обследовании выявлены грубые звуки дыхания в обоих легких, низкие и глухие тоны сердца, ЧСС 150/мин, галопирующий ритм, пансистолический шум 3 ст. в прекардиальной области, нижняя граница печени достигала малого таза.
Ряд лабораторных показателей, в том числе ГГБ, средний корпускулярный объем, средний корпускулярный гемоглобин, средняя концентрация корпускулярного гемоглобина и концентрация ферритина, были снижены. Биомаркеры сердечной недостаточности, такие как N-концевой промозговой натрийуретический пептид, были заметно повышены. В анализах мочи и кала отклонений от нормы обнаружено не было.
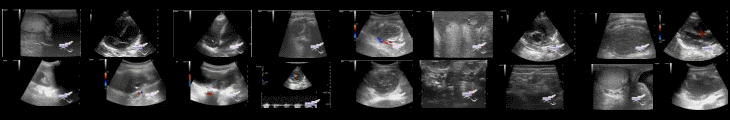
Рентгенограмма грудной клетки показала усиленную текстуру обоих легких и увеличенную тень сердца с кардиоторакальным отношением около 0,62. На электрокардиограмме (ЭКГ) было заподозрено отклонение оси сердца влево, пароксизмальная наджелудочковая тахикардия с ЧСС 150/мин и изменениями сегмента ST-T. Цветная допплер-эхокардиография (ЭхоКГ) показала увеличение левых отделов сердца, утолщение задней стенки левого желудочка, незначительную митральную регургитацию, гипокинез стенок желудочков и снижение функции левых отделов сердца. Кардиомагнитный резонанс (CMR) выявил небольшое утолщение эндокарда левого желудочка, незначительное утолщение миокарда и диффузное уменьшение движения стенки желудочка без явных аномалий замедленного контрастирования. Цветное УЗИ брюшной полости показало кисту печени (размер: 0,93 см х 0,75 см), двусторонние множественные кисты почек (размер самой большой: 1,1 см х 1,7 см) и заметно увеличенную печень с КВР правой доли 8,25 см, нижний край печени был на 6,32 см от края правой нижней реберной дуги по среднеключичной линии.
Были организованы экстренные консультации по различным дисциплинам, включая респираторную медицину, кардиологию, гематологию. На основании клинической симптоматики, признаков, результатов лабораторных и визуализационных исследований, соответствующего анамнеза, возраста дебюта и быстрого развития состояния ребенку был предварительно поставлен диагноз острой сердечной недостаточности (ОСН) детского возраста, вызванной эндокардиальным фиброэластазом (ЭФЭ). Что было подтверждено результатом эндомиокардиальной биопсии.
В соответствии со стандартными рекомендациями по расширенной реанимации для детей ребенок был переведен в реанимацию и контролировался на предмет основных показателей жизнедеятельности, ему вводили кислород через назальную канюлю (скорость потока кислорода: 6 л/мин), а также применяли хлорпромазин 1 мг/кг и прометазин 1 мг/мин. кг путем внутримышечной (в/м) инъекции, усиление сократительной способности сердца при внутривенном (в/в) введении седиланида в дозе 10 мг/кг (половина от общего количества вводится в первый раз, а оставшееся количество вводится в два приема каждые 6 ч), форсированный диурез 0,1 мг/кг фуросемида в/в. (каждые 6 часов) и купирование бронхоспазма и уменьшение отека миокарда с помощью 0,5 мг/кг дексаметазона в/в капельно. После проведенных реанимационных мероприятий ребенок заснул спокойно с ЧСС 147/мин, частотой дыхания 43/мин, чрескожной сатурацией кислорода 95-99%, под контролем прикроватного монитора. Анемию лечили с помощью регулярных пищевых добавок железа во время госпитализации. На 2-е сутки обхода ребенок был в плохом общем состоянии, с грубым дыханием в обоих легких, низкими и глухими тонами сердца, но стабильным дыханием, после физической активности ЧСС 140/мин. Цедиланид назначали в качестве поддерживающей дозы для консолидирующей терапии, витамин С вводили внутривенно для питания миокарда и внимательно наблюдали за изменениями состояния. На 3-и сутки обхода палаты общее состояние ребенка улучшилось, дыхание стабилизировалось, ЧДД 45/мин, тоны сердца сильные и ритмичные, ЧСС 120/мин. Гепатомегалия значительно уменьшилась, нижняя граница печени располагалась примерно на 3 см у края нижней реберной дуги по правой среднеключичной линии. ЭхоКГ на месте продемонстрировала, что увеличенное левое сердце начало уменьшаться. После этого в качестве поддерживающей терапии был продолжен прием низких доз седиланида и контролировался статус сердечного ритма. На 4-е сутки обхода состояние ребенка было относительно стабильным, ЧСС 105-120/мин в покое, перкутанная сатурация кислорода более 95%. Были повторно исследованы соответствующие анализы крови, постепенно все лабораторные показатели пришли в норму. Поддерживаемая доза цедиланида снова вводилась для продолжения лечения, и наблюдались незначительные изменения в состоянии. На 7-е сутки обхода палаты показатели жизнедеятельности ребенка были стабильными, дыхание незначительно учащенное, ЧСС 116/мин, частота дыхания 41/мин. Нижний край печени располагался примерно на 2 см у нижнего края реберной дуги по правой срединно-ключичной линии, селезенка под левым ребром не пальпировалась. После лечения у ребенка не было отеков на обеих нижних конечностях, а время наполнения капилляров составляло около 2 с. В тот же день были повторно исследованы соответствующие анализы крови, и ряд лабораторных показателей, в том числе гематокрит, СРБ и СО2СВ, нормализовались.
После правильного, своевременного и эффективного лечения ребенок выписан на 7-е сутки после поступления без осложнений. Результат повторного обследования рентгенограммы органов грудной клетки показал, что увеличенная тень сердца несколько втянута. Точно так же результаты компьютерной томографии (КТ) грудной клетки и брюшной полости показали, что размер увеличенного сердца незначительно уменьшился, а гепатомегалия значительно уменьшилась. После того, как ребенок был выписан из больницы, ее анемия резко улучшилась благодаря сочетанию перорального препарата (глюконат железа: 3 мг за раз, три раза в день) и приему пищевых добавок железа. Кроме этого, ребенок принимал дигоксин перорально в низких дозах прерывисто (0,05 мг однократно, 1 раз в 12 ч) без признаков рецидива или обострения сердечной недостаточности в течение 9-месячного периода наблюдения.
ЭФЭ является одной из важных причин сердечной недостаточности у младенцев и детей раннего возраста. Встречается у 1/5000 живорожденных и составляет от 1% до 2% врожденных пороков сердца, имеет неизвестную этиологию и генетические характеристики, может возникать при отсутствии пороков сердца. Чем моложе возраст начала заболевания у детей с ЭФЭ, тем хуже прогноз и выше смертность. Из-за отсутствия специфичности клинических проявлений этого заболевания его часто путают с пневмонией, миокардитом и другими заболеваниями, поэтому клинический диагноз до получения результатов эндомиокардиальной биопсии затруднен, особенно в сочетании с другими первичными кардиомиопатиями, которые могут вызвать увеличение левого желудочка, клиническая картина ЭФЭ может быть замаскирована, с высоким риском пропущенного и/или ошибочного диагноза.
Данные доказательной медицины указывают на то, что ОСН, вызванная ЭФЭ, имеет разрушительное течение и тяжелый прогноз. Золотым стандартом диагностики и дифференциальной диагностики ЭФЭ является эндомиокардиальная биопсия; однако результат биопсии требует длительного времени ожидания. В течение этого временного окна клиницисты часто сначала должны обратиться к рентгенограммам грудной клетки, ЭКГ, ЭхоКГ и соответствующим лабораторным исследованиям для первоначальной диагностики и раннего ведения пациентов, что является отличной проверкой личных компетенций и уровня опыта клиницистов. В настоящее время никакие практические рекомендации по диагностике и лечению ЭФЭ до получения результата биопсии ткани не были опубликованы на международном уровне национальными кардиологическими ассоциациями во всем мире. Таким образом, отличить педиатрическую ОСН, вызванную ЭФЭ, от других заболеваний со схожими клиническими симптомами и проявлениями, особенно от дилатационной кардиомиопатии (ДКМП) у младенцев и детей младшего возраста, очень сложно.
Дети в возрасте до 1 года или даже младше с первичным ЭФЭ с большей вероятностью будут точно диагностированы в соответствии с возрастным распределением начала детских пороков сердца. Тем не менее, у детей старше 1 года с редким началом проявления ЭФЭ при визуализации сердца почти идентичны проявлениям ДКМП с ранним началом у младенцев и детей раннего возраста. Оба показывают внезапное расширение полости сердца (левого желудочка) на рентгенограмме грудной клетки или КТ грудной клетки. При более точном обследовании ЭхоКГ в обоих случаях также обнаруживается одинаковый гипокинез стенки желудочка, различная степень утолщения стенки желудочка, регургитация на клапанах сердца и дисфункция левых отделов сердца. И что еще более важно, анализы крови в обоих случаях соответствуют ОСН без какой-либо специфичности. Все это вместе приводит к ошибочной интерпретации причины детской ОСН, как ДКМП, вместо ЭФЭ.
В данном случае у этой 13-месячной девочки внезапно развился ОСН без каких-либо триггеров и без каких-либо инфекций, пороков развития сердца и других сердечно-сосудистых заболеваний в анамнезе. Это относительно редко встречается в клинической практике, так как многие исследования показывают, что респираторные инфекции и врожденные сердечно-сосудистые пороки являются важными триггерами и потенциальными инициаторами развития ОСН, вызванной ЭФЭ. Изначально подозревалась ДКМП до того, как были получены результаты биопсии эндомиокарда, однако эхокардиографические данные показали лишь диффузное и равномерное небольшое утолщение эндокарда левого желудочка с эхогенной плотностью и усилением, а также четкую границу между эндокардом желудочка и миокардом, небольшое утолщение миокарда, лишь небольшой объем митральной регургитации, конечно-диастолический размер левого желудочка 42 мм (< 50 мм). Параллельно с этим последовательности Т1- и Т2-взвешенных изображений МРТ ребенка продемонстрировали общее утолщение эндокарда. Фактически при ДКМП возможное утолщение стенки желудочка будет проявляться не утолщением эндокарда, а скорее утолщением миокарда, и фиброзные изменения, подобные ЭФЭ, при этом утолщении отсутствуют. В таких случаях при ДКМП на фоне ОСН возможно незначительное снижение показателей систолической функции левого желудочка на ЭхоКГ. Кроме того, хотя ЭКГ-проявлениями как ДКМП, так и ЭФЭ у младенцев и детей раннего возраста являются высокий вольтаж левого желудочка, плохая прогрессия зубца R, изменения сегмента ST-T и различные аритмии, первичными характеристиками первого обычно являются предсердная тахикардия и фибрилляция предсердий. Все они заметно отличаются от ЭФЭ. Следует отметить, что ЭхоКГ у постели больного на 3-й день госпитализации показала, что расширенные левые отделы сердца начали уменьшаться, что почти невозможно при ДКМП. Потому что, несмотря на то, что ДКМП можно купировать, но уменьшить размеры сердца до нормы сложно. В сочетании с возрастом ребенка, семейным анамнезом и результатами консультаций с врачами из разных отделений, было принято единодушное мнение о том, что ЭФЭ следует отдать более высокий диагностический приоритет. После получения более убедительных доказательств, указывающих на ЭФЭ, был поставлен предварительный диагноз ОСН, вызванной ЭФЭ, еще до получения результата биопсии, что позволило выиграть драгоценное время для раннего своевременного и правильного вмешательства при прогрессировании заболевания у ребенка. Результат эндомиокардиальной биопсии в конечном итоге подтвердили правильность диагноза.
К сожалению, четких рекомендаций по терапии при ЭФЭ неизвестен из-за редкости этого состояния. Тем не менее, восстановление увеличенного сердца и утраченной сердечной функции у детей с ЭФЭ возможно, и в настоящее время рекомендуемое клинически лечение обычно следует за стандартизированной и энергичной деконгестивной терапией, основанной на сердечных гликозидах. Ребенок придерживался такого принципа лечения с момента поступления до 9-месячного периода наблюдения после выписки, и это лечение в стационаре и на дому помогло ей сохранить устойчивость противоотечной терапии. В последние годы долгосрочные последующие исследования показали, что биоиммунотерапия увеличивает клиническую пользу у детей с ЭФЭ и помогает уменьшить гиперплазию эндокарда и фиброз. Учитывая риск инфицирования в будущем кист печени и почек у ребенка и сопутствующие соматические заболевания, не было возможности применять стероидные гормоны или другие биологические иммуномодуляторы. Тем не менее, авторы статьи рекомендуют использовать биологические иммуномодуляторы для тех детей с ЭФЭ, у которых есть показания, поскольку они могут улучшить прогноз сердечной недостаточности. По сравнению с ЭФЭ, хотя ДКМП также лечат в фазе обострения с использованием подхода к лечению сердечной недостаточности, её обычно лечат длительным приемом диуретиков, ингибиторов ангиотензинпревращающего фермента, блокаторов рецепторов ангиотензина и бета-блокаторов для контроля прогрессирования ОСН и ремоделирование желудочков из-за необратимого увеличения сердца и снижения сердечной функции. Кроме того, хотя биоиммунотерапия при ДКМП у взрослых, по-видимому, приносит пользу части пациентов, на сегодняшний день такие методы лечения не дали достаточных результатов при педиатрической ДКМП, и нет никаких доказательств того, что использование стероидных гормонов снижает смертность и заболеваемость у детей с ДКМП. В результате схемы лечения ЭФЭ и ДКМП у младенцев и детей раннего возраста не всегда идентичны, а ранний ошибочный диагноз и неправильное лечение могут иметь потенциально непредвиденные последствия для прогноза ребенка.
В младенчестве и раннем детстве ЭФЭ часто проявляется как ДКМП и неблагоприятным течением, что затрудняет для клиницистов разграничение этих двух заболеваний. В то время как в случае, о котором здесь сообщается, ЭФЭ был успешно дифференцирован от ДКМП, ещё до получения результата патологоанатомического исследования, и был больше основан на обширном клиническом опыте.
*Также в публикации присутствуют рентгеновские снимки, а также снимки УЗИ, КТ, МРТ и микропрепаратов.
*комментарии редактора