Комплексное фокусное УЗИ у нейрокритических пациентов
Метки: Последние публикации, ТКДГ, УЗДГ, УЗИ сосудов, ангиология, дайджест, неврология, новости
Содержание:
- Быстрое обнаружение ОКС при ишемическом инсульте
- Протокол для ускоренного нейрососудистого ультразвукового исследования
- А. Клиническая диагностика церебральной ишемии в переднем кровообращении
- Шаг 1: Транскраниальный допплер:
- Шаг 2: Сонный / позвоночный дуплекс:
- Б. Клиническая диагностика церебральной ишемии в задней области кровообращения
- Шаг 1: Транскраниальный допплер:
- Шаг 2: Дуплексное УЗИ позвоночных/сонных артерий:
- Мониторинг вазоспазма после САК
- Выявление повышенного ВЧД
- 1. ТКДГ артерий
- 2. ТКДГ вен
- 3. Двух глубинная ТКДГ
- 4. Диаметр оболочки зрительного нерва
- Прикроватное кардиоторакальное УЗИ для нейрокритических пациентов
- Заключение
По данным публикации в журнале Нейросонологии и Нейровизуализации (Journal of Neurosonology and Neuroimaging) за июнь 2019 - Neurosonology for Unconscious or Neurocritically Ill Patients / Нейросонология для пациентов без сознания или больных с нейрокритическими заболеваниями - внешняя ссылка
Измененный психический статус - это частая главная жалоба пациентов, которые обращаются в отделение неотложной помощи, и частая причина неврологических консультаций. Наиболее распространенные этиологические причины, объясняющие изменение психического статуса: неврологические (28%) и токсикологические (21%), после чего следуют травматические (14%), психиатрические (14%), инфекционные (10%), эндокринные / метаболические (5%), легочные (3%), онкологические (3%), сердечно-сосудистые (1%), желудочно-кишечные (1%), и почечные (1%). Крайней формой измененного психического статуса является кома, для которой характерно отсутствие возбуждения и осознания себя и окружающей среды, которое длится более 1 часа. Для таких пациентов жизненно важными могут быть своевременные медицинские и хирургические вмешательства и первоначальная оценка таких пациентов имеет решающее значение для установления правильного диагноза. Таким образом, в руководстве по неотложной неврологической поддержке жизни предлагается алгоритм начальной оценки и лечения пациентов с комой, основанный на общих физических обследованиях, стабилизации дыхательных путей, дыхания, кровообращения, бандаже шейного отдела позвоночника, неврологической оценке, визуализации мозга.
Согласно этим рекомендациям, компьютерная томография головного мозга (КТ) и КТ-ангиография рекомендуются в качестве основного метода визуализации. Визуализация мозга помогает врачам определить структурную этиологию комы, включая инфаркт головного мозга, внутричерепное кровоизлияние, образования головного мозга, отек головного мозга и острую гидроцефалию, вызывающую повышение внутричерепного давления (ВЧД). Полученная информация о сосудистой проходимости полезна для применения реперфузионной терапии при остром инсульте или для прогнозирования спазма сосудов у пациентов с субарахноидальным кровоизлиянием (САК). Прикроватная нейросонология(*авторы предпочли использовать термин нейросонология для обозначения транскраниального УЗИ,а не нейросонография) может помочь в оценке и ведении таких пациентов. В определенных ситуациях это может быть даже предпочтительнее, чем компьютерная томография. Например, в условиях первичной медицинской помощи или на догоспитальном этапе нейросонология гораздо более доступна, чем КТ головного мозга. Кроме того, УЗИ более практично для ситуаций, когда требуется информация о последовательных временных изменениях внутричерепных параметров.
Кардиоторакальное прикроватное УЗИ (*POCUS, см. - POCUS :: Словарь - Для врачей УЗИ :... ) - это еще один метод, часто используемый для пациентов с нейрокритическими состояниями. Нейрокритические пациенты часто проявляют другие медицинские проблемы. Следовательно, своевременная оценка сопутствующих заболеваний сердца и проблем с дыхательными путями или легочными заболеваниями очень важна. Кроме того, оценка гемодинамического статуса пациента полезна в ситуациях, когда необходима оптимизация церебрального перфузионного давления. Ультразвуковое исследование может помочь в диагностике и мониторинге таких пациентов.
В этом обзоре описываются различные ультразвуковые методы, которые используются для оценки пациентов с измененным психическим статусом или нейрокритических больных, с акцентом на выявление окклюзии крупных сосудов (ОКС) при ишемическом инсульте, мониторинг вазоспазма после САК, неинвазивная идентификация ВЧД, и практическое использование кардиоторакального УЗИ у пациентов с нейрокритическими состояниями.
Быстрое обнаружение ОКС при ишемическом инсульте
Обнаружение внутричерепной ОКС с помощью ультразвуковой транскраниальной допплерографии (ТКДГ) фокусированной на степени тромболизиса при ишемии головного мозга (ТпИГМ), которая насчитывает шесть степеней.
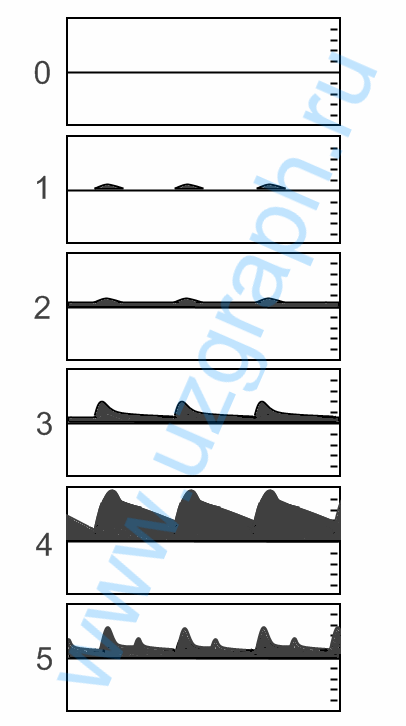
Рис. Степени тромболизиса при ишемии головного мозга по кривой (*слепого) спектрального допплера. 0 ст. кровотока нет на уровне сегментов М1-М2(*сегменты СМА) бифуркация(40мм - *дистанции слепого допплера); 1 ст. нет диастолического потока или присутствует реверберация потока(45мм) ; 2 ст. сглаженный систолический поток, минимальный диастолический, ПИ < 1,2(50мм); 3 ст. нормальное систолическое ускорение потока, снижение Ср.ЛСК > 30%(55мм). Присутствие ТпИГМ классов 0–3 в сосуде, снабжающем ишемизированную территорию, является основным критерием наличия артериальной окклюзии. На это также может влиять расстояние до окклюзии от точки получения допплеровского спектра.
Основные выводы, которые следует учитывать, это снижение среднего значения скорость потока > 30%, выравнивание систолического ускорения, отсутствие диастолического потока или отсутствие потока. В этой системе оценок формы волны ТпИГМ классов 0 (без потока), 1 (минимальный), 2 (сглаженный) и 3 (ослабленный) считаются репрезентативными для окклюзии. На уровень ТпИГМ также могут влиять точка получения спектра и расстояние от этой точки до окклюзии. Вторичные результаты, включая увеличение скорости кровотока в соседней артериальной сосудистой сети, развитие заметных коллатералей или реверсия потока, дистальная по отношению к окклюзии, могут также свидетельствовать в пользу окклюзии. Используя первичные и вторичные признаки, ТКДГ в исследовании, в котором участвовали 190 пациентов, была выявлена артериальная окклюзия с общей чувствительностью 83,0% и специфичностью 94,4%, в сравнении с цифровой ангиографией или магнитно-резонансной ангиографией. Результаты были выше для окклюзии средней мозговой артерии (СМА) (чувствительность 93%; специфичность 98%) и дистальной внутренней сонной артерии (ВСА) (чувствительность 81%; специфичность 96%) и ниже для окклюзии основной артерии ( чувствительность - 60%; специфичность - 96%). Также был разработан метод комбинированного ультразвукового исследования шейных и транскраниальных сосудов для выявления пациентов с ОКС с острой церебральной ишемией. Одновременное обследование у невролога и опытного нейросонографа позволяет проводить целенаправленное ТКДГ и допплерографию шейных сосудов в течение 10 минут(*а почему не за 5 секунд? :))). В исследовании 150 пациентов подряд это ускоренное нейрососудистое ультразвуковое исследование выявило патологии, пригодные для интервенционного лечения, включая окклюзию, субокклюзию, стеноз > 50% или тромб, в артериях с чувствительностью 100% и специфичностью 100%. Использование энергетического допплеровского М-режима (ЭДМ) также может помочь в диагностике артериальных окклюзий, в которых сигнатура высокого сопротивления с отсутствующим диастолическим потоком предполагает артериальную окклюзию. Используя ранее упомянутые критерии ТКДГ и ЭДМ, окклюзия была обнаружена со 100% чувствительностью и 94,5% специфичностью в передней циркуляции, тогда как чувствительность была ниже в задней циркуляции (чувствительность 93%; специфичность 98%).
Протокол для ускоренного нейрососудистого ультразвукового исследования
Используйте портативные устройства с ярким дисплеем, преодолевающим комнатное освещение. Встаньте за подголовник пациента. Начните с ТКДГ, потому что острая окклюзия, ответственная за неврологический дефицит, вероятно, расположена интракраниально. Экстракраниальный каротидный / позвоночный дуплекс может выявить дополнительные нарушения, часто ответственные за нарушение внутричерепного кровотока.
А. Клиническая диагностика церебральной ишемии в переднем кровообращении
Шаг 1: Транскраниальный допплер:
1. Если позволяет время, начните УЗИ со стороны, не подверженной воздействию, чтобы установить нормальную форму волны в СМА (глубина M1 45–65 мм, глубина M2 30–45 мм) и скорость для сравнения с пострадавшей стороной;
2. Если не хватает времени, начните с пораженной стороны: сначала оцените СМА на глубине 50 мм. Если сигналы не обнаружены, увеличьте глубину до 62 мм. Если обнаружен антеградный сигнал потока, уменьшите глубину, чтобы отследить ствол СМА или определить наихудший остаточный сигнал потока. Поиск возможного отклонения потока к ПМА(*передняя мозговая артерии), ЗМА(*задняя мозговая артерия) или M2 СМА. Оценить и сравнить формы сигналов и систолическое ускорение потока;
3. Продолжайте движение по пораженной стороне (трансорбитное окно). Проверьте направление потока и пульсацию в ГА(*глазной артерии) на глубине 40–50 мм, а затем на сифоне ВСА на глубине 55–65 мм;
4. Если позволяет время или у пациентов с чисто моторными или сенсорными нарушениями, оцените БА(*базилярная/основная артерия) (глубина 80–100 + мм) и терминальный отдел ПА(*позвоночная артерия) (40–80 мм).
Шаг 2: Сонный / позвоночный дуплекс:
1. Начните с пораженной стороны в поперечных плоскостях B-режима, а затем включите цветной(*ЦДК) или энергетический допплеровский режимы от проксимального до дистального сегментов сонной артерии. Определите ОСА(*общая сонная артерия) и ее бифуркацию по B-режиму и режимам картирования потока(*ЦДК и др.);
2. Отметьте, если ВСА (или ОСА) имеет поражение в B-режиме и соответствующую турбулентность на изображениях потока. У пациентов с сопутствующей болью в груди оцените ОСА как можно ближе к точке отхождения;
3. Выполните измерения спектральной скорости с поправкой на угол в средней и дистальной ОСА, ВСА и наружной сонной артерии;
4. Если позволяет время или у пациентов с чисто моторными или сенсорными нарушениями, осмотрите шейный отдел позвоночных артерий (продольный B-режим, цветной или энергетический режимы, спектральный допплер) на пораженной стороне;
5. Если позволяет время, выполните поперечное и продольное сканирование артерий на стороне, не подвергшейся воздействию.
Б. Клиническая диагностика церебральной ишемии в задней области кровообращения
Шаг 1: Транскраниальный допплер:
1. Начните с субокципитального доступа и глубины 75 мм (соединение ПА) и определите поток в БА на уровне 80–100 + мм.
2. Если присутствует ненормальный спектр на глубине 75–100 мм, найдите конечный отдел ПА (40–80 мм) на стороне, не подверженной воздействию, для сравнения и оцените конечный отдел ПА на стороне с изменениями на аналогичной глубине.
3. Перейдите к трансвисочному доступу, чтобы оценить ЗМА (55-75 мм) и возможный коллатеральный поток через заднюю соединительную артерию (проверьте обе стороны).
4. Если позволяет время, оцените как СМА, так и ПМА (60–75 мм) на предмет возможного компенсаторного увеличения скорости потока, как косвенного признака обструкции базилярной артерии.
Шаг 2: Дуплексное УЗИ позвоночных/сонных артерий:
1. Начните с пораженной стороны, определив местонахождение ОСА с использованием продольной плоскости B-режима, и направьте датчик вниз(*кзади), чтобы визуализировать тени от поперечных отростков срединных шейных позвонков.
2. Примените режимы цветного или энергетического картирования, а также спектральный допплер, чтобы идентифицировать поток во внутрипоперечных сегментах ПА.
3. Следуйте курсу ПА до её начала и получите доплеровские спектры. Выполните аналогичное обследование на другой стороне.
4. Если позволяет время, проведите двустороннее дуплексное исследование ОСА, ВСА и наружной сонной артерии, как описано выше.
Другое преимущество ТКДГ заключается в том, что её можно выполнять у постели больного, т.к. аппарат УЗИ можно переносить в руках(*это если имеется переносной аппарат, т.е. не каждый аппарат УЗИ можно перенести в руках). Успех испытаний эндоваскулярного лечения увеличил потребность в идентификации пациентов с ОКС. Более ранняя идентификация в догоспитальных условиях поможет в сортировке пациентов, нуждающихся в комплексных центрах инсульта, и увеличит число пациентов, которым будет полезна эндоваскулярная терапия. Регенсбургский(*город в Германии) мобильный проект по инсульту фокусируется на таких проблемах, и авторы выдвинули гипотезу, что невролог, оснащенный портативным ультразвуковым устройством, сможет достичь диагностической точности «в полевых условиях», которая аналогична той, которая достигается при продвинутой нейровизуализации в стационаре (КТ ангиография и магнитно резонансная ангиография)(*мечтать не вредно!). Оценки транскраниальной цветной сонографии ( *а точнее допплерографии, т.е. ТКЦДГ) были выполнены в догоспитальных «911» ситуациях экстренного инсульта, где портативные дуплексные ультразвуковые устройства использовались для визуализации СМА с двух сторон. У 113 подходящих пациентов ТКЦДГ имела чувствительность 90% и специфичность 98% для выявления окклюзии M1. Однако из 102 выполненных ТКЦДГ было выявлено 10 окклюзий, что является низким показателем с учетом клинических усилий. Кроме того, до 20% пациентов имеют плохие височные окна(*как сказал один из моих преподавателей одному пациенту из силовых структур - "У вас не череп, а каска!" При его работе - это хорошо, а вот для ТКДГ нет. :)), что является еще одним ограничением. Использование предгоспитальных шкал инсульта для прогнозирования ОКС, таких как полевая оценка инсульта для экстренного назначения (FAST-ED *причем для этого есть даже приложения для смартфонов - внешняя ссылка ) или другого - Зрение, афазия, неглект (VAN *причем указанный протокол рассчитан на средний мед.персонал - внешняя ссылка ) вместе с ТКДГ у пациентов с подозрением на ОКС может быть в состоянии преодолеть такие ограничения(*А еще можно монетку подбросить, но лучше всё-таки сделать ангиографию).
Нейросонологические исследования также могут играть роль в мониторинге пациентов после процедур реканализации. В самом деле, ТКДГ можно использовать как суррогатный маркер для реперфузии, так и для метода выявления эмболии, тромбоза, гипоперфузии и гиперперфузии. Кроме того, ТКЦДГ может помочь в оценке состояния сонной артерии или экстракраниальной позвоночной артерии после стентирования. В связи с изменениями кровотока и податливости сосудов для ВСА используются модифицированные критерии для рестеноза стента, на основании соотношения систолических скоростей ВСА / ОСА.
Мониторинг вазоспазма после САК
Спазм сосудов головного мозга является основной причиной заболеваемости и смертности после аневризматического САК. До 70% пациентов испытывают ангиографический вазоспазм, который обычно возникает между 5 и 14 днями после появления САК. Симптоматический вазоспазм встречается у ~ 30% пациентов. Отсроченный ишемический неврологический дефицит встречается у ~ 50% пациентов с ангиографическим вазоспазмом. В современных руководствах Американского общества нейровизуализации подчеркивается полезность ТКДГ для диагностики церебрального вазоспазма как в переднем, так и в заднем кровообращении после САК. ТКДГ может использоваться для выявления развития вазоспазма до того, как это станет клинически очевидным (2–5 дни), и определения прогрессирования до тяжелой фазы спазма, когда развитие отсроченного ишемического дефицита является наибольшим (5–12 дни). Таким образом, результаты ТКДГ могут помочь в планировании соответствующих терапевтических вмешательств. Однако, есть некоторые споры о клинической пользе ТКДГ для мониторинга вазоспазма. Недавний метаанализ Mastantuono et al. 2018г. выявил консервативные результаты, демонстрирующие объединенную чувствительность 66,7% (95% доверительный интервал [ДИ], 55,9–75,9) и специфичность 89,5% (95% ДИ, 80,3–94,7) для ТКДГ при обнаружении спазма сосудов в СМА. Также ТКЦДГ не показало убедительных результатов в пользу дополнительной точности, по сравнению с обычной ТКДГ. Авторы пришли к выводу, что ТКДГ, как и ТКЦДГ способны обнаруживать спазм сосудов в СМА, но ни один из них не полезен для исключения возможности спазма сосудов(*т.е. низкая чувствительность - 66,7%). Кроме того, для артерий, отличных от СМА, полезность ТКДГ остается неясной(*Правильно, их еще хуже, если вообще, видно).
Поскольку внутричерепная область покрыта толстым черепом, золотые стандартные методы измерения ВЧД по своей природе инвазивны. Инвазивный мониторинг ВЧД особенно важен после тяжелой черепно-мозговой травмы. Однако из-за осложнений инвазивных методов, включая инфекцию и/или кровоизлияние, развиваются методы надежной неинвазивной оценки ВЧД(*как только вы слышите термин "надежный", будьте настороже, т.к. для действительно надежных инструментов лишний раз это подчеркивать нет необходимости). Среди них обнаружение изменений мозгового кровотока (МК) на основе ТКДГ и определение по УЗИ увеличения диаметра оболочки зрительного нерва (ДОЗН) - это легко доступные, безопасные и надежные методы, которые можно выполнять у постели больного.
Пульсационный индекс (PI; [пиковая систолическая скорость - конечная диастолическая скорость] / средняя скорость потока) является широко исследованной переменной измерений ТКДГ для ВЧД, но исследования, оценивающие его точность, показали противоречивые результаты. Bellner et al. 2004г. сообщили, что у пациентов с различными внутричерепными нарушениями с внутрижелудочковыми катетерами коэффициент корреляции между ВЧД и PI составлял 0,828; этот метод имел чувствительность 83% и специфичность 99% для выявления ВЧД > 20 мм рт.ст. Однако Zweifel et al. 2012г. при исследовании 290 пациентов с черепно-мозговой травмой сообщили, что корреляция между PI и ВЧД составила 0,31. (р <0,001), а между PI и церебральным перфузионным давлением (ЦПД) было –0,41 (р <0,001). Интервал прогнозирования 95% значений ВЧД для данного PI составлял более ± 15 мм рт.cт., а для ЦПД - более ± 25 мм рт. Таким образом, авторы пришли к выводу, что общая полезность PI ТКДГ для неинвазивной оценки ВЧД и ЦПД очень ограничена(*что и следовало ожидать), и для поддержки решений по инвазивному мониторингу ВЧД следует использовать только экстремальные значения PI.
Schmidt et al. 2000г. оценили метод оценки ВЧД, применяя математическую модель «черного ящика», в которой внутричерепной отдел считался системой черного ящика, при этом ВЧД определялось как реакция на входящий сигнал артериального давления (АД). Процесс преобразования АД в форму волны ВЧД был изменен в соответствии с изменениями в мозговом кровообращении, которые были получены с использованием характеристик ТКДГ. С помощью этого метода авторы достигли неинвазивного моделирования ВЧД, которое близко имитировало измеренные формы кривой ВЧД.
Другие производные от ТКДГ формулы были получены для получения неинвазивных измерений ВЧД путем оценки ЦПД и вычисления ВЧД на основе предположения, что ВЧД = среднее артериальное давление - ЦПД. Czosnyka et al. 1998г. предложили формулу (ЦПД = среднее АД х диастолическое скорость потока / средняя скорость потока), основанную на наблюдении, что при нарушениях перфузии диастолическая скорость потока падает, тогда как систолическая составляющая остается относительно неизменной. Благодаря этой формуле ошибка в оценке ВЧД составляла <10 мм рт.ст. в 68% измерений.
Также сообщалось об оценке ВЧД путем оценки ЦПД с использованием концепции критического давления закрытия. Критическое давление закрытия обозначает порог АД, ниже которого местное микрососудистое кровяное давление недостаточно для предотвращения коллапса и прекращения кровотока. Используя ТКДГ, критическое давление закрытия можно оценить, сравнивая пульсирующие формы сигналов МК и АД. Предполагая линейную зависимость между МК и АД в течение одного сердечного цикла, можно оценить давление закрытия, например, путем определения точки пересечения линии регрессии между значениями систолического и диастолического АД, нанесенными вдоль оси x, и систолическим и диастолические значения МК, нанесенные вдоль оси y. Критическое давление закрытия равно сумме значений ВЧД и напряжения сосудистой стенки. Используя этот метод, Varsos et al. 2015г. сообщили, что неинвазивная оценка ЦПД показала хорошую корреляцию с инвазивно измеренным ЦПД (r = 0,851, p <0,001), с небольшой ошибкой оценки при применении к серии из 280 пациентов с травмами головы.
Примечательно, что при сравнении четырех вышеупомянутых методов измерения ВЧД через ТКДГ PI модель наиболее точно отражала временные изменения ВЧД, тогда как модель «черного ящика» была наилучшей оценкой для ВЧД в численном виде.
ТКДГ венозной системы также оценивается. Теоретически, церебральная эластичность сильно зависит от сжимаемости венозного сегмента сосудистого русла. Во время повышения ВЧД венозная кровь, вероятно, является первым объемом, который будет вытеснен. Обычно ТКДГ вен выполняется для оценки базальной вены Розенталя через окно височной кости(*транстемпоральное) или для оценки прямого синуса, через затылочное или трансфораминальное(*через межпозвонковое отверстие) окно. Краткий модифицированный маневр(*проба) Вальсальвы выполняется для подтверждения венозной природы. Используя этот метод, Schoser et al. 1999г. продемонстрировали, что в пределах определенного диапазона ВЧД (15–40 мм рт.ст.) максимальная скорость венозного кровотока в базальной вене Розенталя (r = 0,645; p <0,002) и прямом синусе (r = 0,928; p <0,0003) показали линейные отношения с ВЧД. Связь между систолической скоростью прямого синуса и ВЧД была подтверждена последующим исследованием. Однако этот метод ограничен трудностями проведения сигнала от вен, ТКДГ вен может быть недоступна до 12% (базальная вена Розенталя) до 28% (прямой синус) пациентов(*по очень скромным подсчетам).
Ragauskas и соавт. 2012г.( внешняя ссылка ) сообщили о новом неинвазивном подходе к измерению ВЧД, основанном на двух глубинной ТКДГ глазной артерии (ГА). В этом методе ГА используется в качестве естественной пары шкал, в которых внутричерепной сегмент ГА сжимается с помощью ВЧД, а экстракраниальный сегмент ГА сжимается за счет экстракраниального давления, прикладываемого к орбите(*см. рисунок устройства чем-то напоминающий манжету для ручного измерения АД - внешняя ссылка ). Параметры кровотока в обоих сегментах ГА примерно одинаковы, когда экстракраниальное давление равно ВЧД. Используя этот метод, авторы сообщили о хорошей точности, о чем свидетельствует низкая средняя систематическая ошибка (0,12 мм рт.ст., уровень достоверности 0,98) и низкое стандартное отклонение парных записей (2,19 мм рт.ст.; уровень достоверности, 0,98). Однако этот подход требует дополнительного конкретного устройства для измерения параметров ТКДГ, как на внутричерепной, так и на внечерепной части ГА. Кроме того, он может иметь ограниченное применение у пациентов с травмой глаза, тяжелой травмой головы или переломами черепа.
4. Диаметр оболочки зрительного нерва
Было установлено, что ДОЗН является сильным предиктором повышения ВЧД с высокой чувствительностью и специфичностью. По сравнению с другими неинвазивными методами оценки ВЧД, такими как ТКДГ артерий и вен, ДОЗН обладает более сильной прогностической силой. Измерение ДОЗН является практичным из-за его неинвазивного характера, воспроизводимости и относительно низкой стоимости.
Существует прямая связь между субарахноидальным пространством зрительного нерва и хиазматической цистерной. Когда ВЧД поднимается, спинномозговая жидкость течет к субарахноидальному пространству зрительного нерва, что приводит к расширению дуральной оболочки и увеличению ДОЗН. Это изменение наиболее очевидно в переднем сегменте твердой мозговой оболочки, на глубине 3 мм от глазного яблока, что делает эту позицию предпочтительной для измерения. Изменения в ДОЗН также считаются динамическим явлением, а не статическим индикатором увеличения ВЧД, что делает использование оценок ДОЗН более практичным у постели больного.
В качестве общего подхода, обычно используется значение > 5,0–6,0 мм в качестве критерия внутричерепной гипертензии. Однако в своем метаанализе и обзоре Robba et al. 2018г. указали, что существует неоднорость в пороговых значениях для определения внутричерепной гипертензии; таким образом, четкое предельное значение для ДОЗН пока не определено.
Межиндивидуальные различия в ДОЗН значительны. Помимо повышения ВЧД, ряд базовых факторов может влиять на ДОЗН. Этнос, пол, и индекс массы тела, как известно, связаны с ДОЗН. В частности, ДОЗН показывает сильную корреляцию с поперечным диаметром глазного яблока (ПДГЯ). Следовательно, использование отношения ДОЗН / ПДГЯ может быть лучшим маркером повышенного ВЧД. Это соотношение не только корректируется ПДГЯ, но также становится независимым от таких демографических факторов, как пол, рост, вес и индекс массы тела. В одной из публикаций было установлено среднее отношение ДОЗН / ПДГЯ 0,18 (95% ДИ, 0,18–0,18) среди здоровых корейцев.
Динамические изменения в ДОЗН также могут быть оценены, а не только одно измерение ДОЗН. Существуют доказательства того, что ДОЗН увеличивается с увеличением ВЧД и уменьшается с уменьшением повышенного ВЧД. С такими накопленными результатами исследований изменения ДОЗН могут использоваться в качестве динамического маркера изменений ВЧД. Как и инвазивный мониторинг ВЧД, изменения ДОЗН могут направлять реализацию терапевтических вмешательств.
Хотя измерение ДОЗН является относительно простой процедурой, необходимо позаботиться о том, чтобы обеспечить их точность. Когда пациент находится в положении лежа, линейный датчик для УЗИ располагается над верхним веком. Из этого доступа, эхогенный ретробульбарный жир находится за пределами глазного яблока(ГЯ). Зрительный нерв наблюдается как четко определенная однородная гипоэхогенная полоса, а его оболочка - как двусторонняя тонкая гипоэхогенная линия, которая латеральна и параллельна нерву. Зрительный нерв измеряется на расстоянии 3 мм кзади от ГЯ. Важно измерять ДОЗН по линии, перпендикулярной направлению зрительного нерва. Двусторонние измерения ДОЗН и измерения в коронарной плоскости должны выполняться для точности. Для контроля качества необходимо получить в среднем два или три измерения с каждой стороны.
Прикроватное кардиоторакальное УЗИ для нейрокритических пациентов
Ультразвуковое исследование у постели больного может включать в себя серию целенаправленных ультразвуковых исследований для эффективной диагностики или исключения определенных состояний у пациентов с определенными симптомами, включая гипотензию, боль в груди или одышку. В качестве альтернативы это может помочь врачу в диагностике и мониторинге критически больных пациентов. Ультразвуковое исследование на месте оказания медицинской помощи особенно ценно у пациентов, нуждающихся в нейрокритическом уходе, из-за частых системных сопутствующих заболеваний у этих пациентов. УЗИ можно использовать у постели пациента в различных ситуациях, в том числе для 1) оценки сопутствующих кардиоторакальных заболеваний, таких как дефект межпредсердной перегородки и открытое овальное окно(*видимо в Корее ООО причисляют к заболеваниям), общая / сегментарная дисфункция желудочков, перикардиальный выпот / тампонада сердца, источники эмболии при поступлении в отделение нейрокритической помощи; 2) дифференциальная диагностика острых симптомов, включая гипотензию, боль в груди и одышку; 3) последовательное наблюдение за легочными или кардиологическими дисфункциями, такими как улучшение или обострение отека легких или пневмонии; и 4) оценка и управление статусом объема в ситуациях, когда необходима оптимизация церебрального перфузионного давления, включая гипертоническую терапию при ишемическом инсульте или предотвращение отсроченной церебральной ишемии после САК.
Для этих пациентов может быть последовательно проведено ультразвуковое исследование легких, эхокардиография и ультразвуковое исследование сосудов (нижняя полая вена [НПВ], аорта и глубокие вены нижней конечности). Хотя не существует общепринятой последовательности, сканирование легких и НПВ с брюшной аортой, с последующей оценкой сердца и брюшной полости, когда это необходимо, целесообразно. Сонография глубоких вен нижних конечностей проводится в клинических ситуациях при необходимости. На протяжении всего этого процесса требуется доказательство «8 Es», мнемоника восьми потенциальных целей для идентификации. Восемь Es(*подразумевается 8 слов начинающихся с англ. Е, для лучшего запоминания, на русском это конечно не так) - пустая грудная клетка (пневмоторакс), отечное легкое, расширенная сфокусированная оценка с сонографией травмы (E-FAST), выпот (перикардиальный), равенство (дисфункция правого желудочка [ПЖ]*под равенством подразумевается одинаковый диаметр ПЖ и ЛЖ), фракция выброса (дисфункция левого желудочка [ЛЖ]), выход (аорта), вход (НПВ) и движения эндокарда(*На анатомии у нас была мнемоника "Как на Lamina Cribrosa восседает Crista Galli", тоже глупость, но запоминается. Человеческий мозг - загадка.).
УЗИ на местах оказания медицинской помощи может быть выполнено с использованием двух датчиков. Первый шаг использует конвексный датчик и начинается с УЗИ легких. Для быстрой оценки ультразвуковое исследование легкого может быть выполнено в двух передних точках легкого и в одной постеролатеральной альвеолярной и / или точке плеврального синдрома (PLAPS - *согласно размещенному в статье рисунку эта точка проецируется на боковые отделы с получением срезов в которых умещаются соответствено печень/селезенка, диафрагма и легкое) для каждого легкого. Можно выделить пять сонографических паттернов(*эхокартин) легких: нормальный паттерн легкого, пневмоторакс, интерстициальный синдром, альвеолярное уплотнение и выпот в плевральную полость. Нормальный паттерн легкого определяется как A-линии (артефакт, образованный повторением плевральной линии) с легким скольжением (динамическое движение плевральной линии, которая движется синхронно с дыханием) в передних отделах легкого, без альвеолярного уплотнения или плеврального выпота в точке PLAPS. Нормальный паттерн легкого может наблюдаться в норме и при заболеваниях дыхательных путей, эмболии легочной артерии при одышке. Диффузный паттерн интерстициального синдрома определяется как множественные двусторонние B-линии, по крайней мере, с двумя позитивными сканами на каждой стороне грудной клетки. Аномальные B-линии классифицируются как >= 3 линий на межреберье, тогда как <= 2 линии считается нормальным. Диффузный интерстициальный синдром может указывать на отек легких, легочный фиброз или интерстициальную пневмонию. Комбинированные эхокардиографические признаки дисфункции ЛЖ с двусторонними B-линиями могут указывать на кардиогенный отек легких. Сонографический диагноз пневмоторакса состоит из трех этапов: 1) отсутствие скольжения легких (наличие скольжения легких наблюдается как симптом морского побережья [стратифицированный рисунок над плевральной линией и песчаный вид ниже плевральной линии в М-режиме], в то время как отсутствие скольжения легких наблюдается как симптом стратосферы [однородная стратифицированная картина в М-режиме, *её еще иногда называют "штрих-кодом"]; 2) отсутствие B-линий и наличие A-линий; и 3) подтверждение точек легкого (чередование признаков побережья и стратосферы). Плевральный выпот или альвеолярные интерстициальные паттерны могут быть идентифицированы в точке PLAPS. Консолидированные области легких визуализируются как тканеподобные структуры(*для обозначения этого часто используется термин "опеченение" легкого).
Далее проводится ультразвуковое исследование сосудов НПВ и аорты. НПВ представляет из себя вход(*Как и ВПВ, которую на УЗИ оценить сложно) в сердце, и ультразвуковые оценки НПВ могут быть использованы для прогнозирования преднагрузки или объемного реагирования. Изменения дыхания можно оценить по так называемому кавальному индексу(*индекс НПВ) ([(диаметр НПВ на выдохе - диаметр НПВ на вдохе) / диаметр НПВ на выдохе] х 100). Прогностическая сила кавального индекса является постоянной у интубированных пациентов. У пациентов с септическим шоком вариабельность в диаметре НПВ при дыхании > 12% предсказывала увеличение сердечного выброса после объемной нагрузки с положительными и отрицательными прогностическими значениями соответственно 93% и 92%. В другом исследовании порог кавального индекса составлял 18%. Однако его способность к прогнозированию менее эффективна для пациентов со спонтанным дыханием. Первоначальные отчеты показали, что значение индекса НПВ > 50% предполагало, что правое предсердное давление < 10 мм рт.ст. В настоящее время оптимальный подход к измерению индекса НПВ у пациентов со спонтанным дыханием состоит в том, чтобы научить их «дышать носом», что приводит к короткому и быстрому выдоху. Европейской ассоциацией эхокардиографии рекомендуется комбинированное использование максимального и минимального диаметров НПВ. Диаметр НПВ <= 2,1 см, который коллабирует > 50%, предполагает нормальное давление в правом предсердии(ПП) 3 мм рт.ст. (диапазон 0–5 мм рт.ст.), тогда как диаметр НПВ > 2,1 см, который коллабирует < 50% на вдохе предполагает высокое давление в ПП 15 мм рт.ст. (диапазон 10–20 мм рт.ст.). Для неопределенных случаев, когда диаметры НПВ не соответствуют этой парадигме, можно использовать промежуточное значение 8 мм рт.ст. (диапазон 5–10 мм рт.ст.). Так же к вторичным критериям повышения давления в ПП относится отношение E/E’ > 6 на трикуспидальном клапане(*если кому интересно, это комбинирование показателей обычного спектрального и спектрального тканевого допплеров - внешняя ссылка ), преобладание диастолического потока в печеночных венах(фракция систолического наполнения > 50%). Желательно, чтобы вторичные показатели повышенного давления в правом предсердии были совмещены с УЗИ брюшной аорты, что может быть выполнено для оценки выходов сердца и выявления признаков расслоения или аневризмы аорты.
Используя датчик с фазированной решеткой(*секторный) может быть выполнена эхокардиография. Её потенциальными целями у пациентов с нейрокритическим уходом являются выпот в перикарде с физиологией тампонады или без нее (диастолический коллапс правого желудочка), легочная эмболия, вызывающая дисфункцию ПЖ (увеличение ПЖ и парадоксальное движение межжелудочковой перегородки), систолическая дисфункция ЛЖ или острый инфаркт миокарда (региональные аномалии движения стенки ЛЖ и ПЖ) и механические осложнения (разрыв папиллярных мышц и разрыв стенки левого желудочка), а также признаки гиповолемического или дистрибутивного шока (гипокинетический левый желудочек малого размера или гиперкинетический левый желудочек нормального размера). Глобальная фракция выброса легко оценивается визуально наряду с региональным движением стенки из длинной оси парастернальной позиции. Дилатация ПЖ, парадоксальное движение перегородки(*МЖП), выпот в перикарде и восходящая аорта также могут быть оценены. Затем датчик поворачивают на 90 ° к левому плечу пациента, чтобы добиться среза по короткой оси парастернальной позиции. Из этой позиции, также оценивается региональное движение стенок ЛЖ. Подсказка в виде "равенства", при дилатации ПЖ или парадоксальное движение перегородки, могут также наблюдаться из этой позиции. Заболевания, вызывающие повышение давления ПЖ, в том числе легочную эмболию и легочную гипертензию, приводят к увеличению ПЖ и компрессии ЛЖ, в результате чего возникает D-образная форма ЛЖ. Напротив, тампонада сердца приводит к парадоксальному диастолическому коллапсу ПЖ. В дальнейшем получается апикальная четырехкамерная позиция. В этой позиции можно оценить общую функцию ЛЖ, а также сравнить размеры ЛЖ и ПЖ и отклонения функции или движения стенки. Для пациентов, у которых не могут быть получены срезы в апикальной четырехкамерный(4К) позиции из-за интубации или постуральных затруднений, можно использовать субкостальную 4К позицию. Для оценки сердечного выброса можно использовать супрастернальную позицию, особенно у пациентов с болью в груди, но оценки из этой позиции не должны проводиться регулярно у нейрокритических пациентов.
УЗИ также используется для диагностики тромбоза глубоких вен нижних конечностей при оценке пациентов с одышкой, имеющих нормальный паттерн легкого или в качестве процедуры скрининга в отделении интенсивной терапии. Был разработан протокол, использующий упрощенную технику компрессии общей бедренной вены и подколенной вены, потому что в предыдущих исследованиях почти во всех случаях тромбоза глубоких вен была задействована либо подколенная, либо общая бедренная вена. Обычно используется линейный датчик, и бедренная вена осматривается от дистального отдела до до точки бедренного треугольника, в которой раздваивается общая бедренная артерия. Подколенная вена может быть визуализирована в подколенной ямке, где вена обычно расположена более близко к подколенной артерии. Если вена компрессируется до тонкой линии при внешнем давлении, предполагается, что она проходима, тогда как если вена не сдавливается, предполагается, что просвет сосуда содержит тромб.
Комплексное УЗИ на месте оказания медицинской помощи, включая ТКДГ, дуплекс сонных и глазных артерий, а также кардиоторакальное УЗИ, является эффективным инструментом, который может помочь неврологам диагностировать и лечить пациентов с измененным психическим статусом, а также пациентов в условиях нейрокритической помощи.
*Также в публикации представлены снимки УЗИ, схемы и пр.
*комментарии редактора